Difundo la traducción de esta artículo del equipo de Ioannidis titulado "SARS-CoV-2 Reinfections: Overview of Efficacy and Duration of Natural and Hybrid Immunity" publicado on line el 8 de este mes de febrero (aquí). Los autores revisan la eficacia de la inmunidad natural, la vacunal y la híbrida por SARS-CoV-2. Utilizan artículos publicados o pre-publicados hasta el 1 de enero de este año. Los autores se muestran algo conservadores al concluir que la inmunidad inducida por la infección es igual de buena o mejor que la proporcionada por la inoculación de dos dosis de vacuna ARNm. Quizá esto forme parte de esa especie de autocensura que muchos se autoimponen para que no parezca que sus palabras, al hablar de la inmunidad natural, van en contra de la bondad inmunitaria de estas vacunas, especialmente cuando pretenden publicar sus textos en revistas científicas. Pero si leemos con detalle el texto descubriremos que la inmunidad natural es, de lejos, más robusta por completa y duradera que la inducida por las vacunas. Lo que no significa que haya que buscar a propósito la infección para evitar la vacunación por los potenciales riesgos de la misma, como el propio texto señala. La inmunidad natural, presente en una parte creciente de la población, no puede seguir siendo ignorada y ha de considerarse en las políticas de salud pública actuales y futuras. Necesitamos con urgencia conocer su alcance en nuestro país mediante un estudio de seroprevalencia de base poblacional cuya iniciativa debería partir del Ministerio de Sanidad.
SARS-CoV-2 reinfections: Overview of efficacy and duration of natural and hybrid immunity
- a
- Department of Internal Medicine, Division of Endocrinology and Diabetology, Medical University of Graz, 8036, Graz, Austria
- b
- Department of Internal Medicine, Division of Infectious Diseases, Medical University of Graz, 8036, Graz, Austria
- c
- Departments of Medicine, Epidemiology and Population Health, Biomedical Data Science, and Statistics, Stanford University, Stanford, CA, 94305, USA
- Una infección previa por SARS-CoV-2 se asocia con un riesgo significativamente reducido de reinfecciones con una eficacia que dura al menos un año y una inmunidad menguante relativamente moderada.
- La inmunidad natural muestra tamaños de efecto aproximadamente similares con respecto a la protección contra la reinfección en diferentes variantes de SARS-CoV-2, con la excepción de la variante Omicron para la cual los datos recién están surgiendo antes de que se puedan sacar conclusiones finales.
- Se reduce el riesgo de hospitalizaciones y muertes en las reinfecciones por SARS-CoV-2 frente a las infecciones primarias.
- La inmunidad natural puede ofrecer una protección igual o mayor contra las infecciones por SARS-CoV-2 en comparación con las personas que reciben dos dosis de una vacuna de ARNm, pero los datos no son totalmente consistentes.
- La inmunidad natural debe considerarse para la política de salud pública con respecto al SARS-CoV-2.
Resumen
Las encuestas de seroprevalencia sugieren que más de un tercio y posiblemente más de la mitad de la población mundial se infectó con el SARS-CoV-2 a principios de 2022. A medida que un gran número de personas siguen estando infectadas, la eficacia y la duración de la inmunidad natural en términos de la protección contra las reinfecciones por SARS-CoV-2 y las enfermedades graves tiene una importancia crucial para el futuro. Esta revisión narrativa proporciona una descripción general de los estudios epidemiológicos que abordan este tema. Las encuestas nacionales que cubren 2020-2021 documentaron que una infección previa por SARS-CoV-2 se asocia con un riesgo significativamente menor de reinfecciones con una eficacia que dura al menos un año y una inmunidad menguante relativamente moderada. Es importante destacar que la inmunidad natural mostró tamaños de efecto aproximadamente similares con respecto a la protección contra la reinfección en diferentes variantes de SARS-CoV-2, con la excepción de la variante Omicron para la cual los datos son tan recientes que no se pueden sacar conclusiones definitivas. El riesgo de hospitalizaciones y muertes también se redujo en las reinfecciones por SARS-CoV-2 frente a las infecciones primarias. Los estudios observacionales indican que la inmunidad natural puede ofrecer una protección igual o mayor contra las infecciones por SARS-CoV-2 en comparación con las personas que reciben dos dosis de una vacuna de ARNm, pero los datos no son totalmente consistentes. La combinación de una infección previa por SARS-CoV-2 y una vacunación, denominada inmunidad híbrida, parece conferir la mayor protección contra las infecciones por SARS-CoV-2, pero quedan varias lagunas de conocimiento sobre este tema. La inmunidad natural al debe ser considerada en la política de salud pública con respecto al SARS-CoV-2.
1 . Introducción
Después del brote de SARS-CoV-2 en diciembre de 2019 en China, se produjo una rápida propagación que condujo a una pandemia mundial de enfermedad por coronavirus 2019 (COVID-19) ( Singh et al., 2021 ; Wu y McGoogan, 2020 ). Las decisiones sobre las medidas contra las infecciones por SARS-CoV-2 suponen un desafío y requieren conocimiento científico sobre su eficacia y sus posibles beneficios y daños ( Ioannidis, 2020a ; Kampf y Kulldorff, 2021 ; Pilz, 2021 ). La vacunación contra el SARS-CoV-2 demostró ser altamente eficaz en ensayos controlados aleatorios (ECA) a corto plazo y efectiva en entornos de la vida real ( Khandker et al., 2021 ; McIntyre et al., 2022 ; Polack et al., 2020) ;Sharif et al., 2021 ). Los informes sobre la disminución de la inmunidad tan pronto como unos meses después de la vacunación plantean un desafío para las estrategias de salud pública ( Chemaitelly et al., 2021b ; Goldberg et al., 2021b ; Levin et al., 2021 ; Rosenberg et al., 2022 ). Se está acumulando evidencia sobre la medida en que las vacunas de refuerzo pueden ayudar a restaurar una protección altamente eficiente contra las infecciones por SARS-CoV-2 y la mortalidad relacionada ( Arbel et al., 2021 ; Bar-On et al., 2021a , 2021b ; Chemaitelly et al. , 2021b ; Goldberg et al., 2021b ; Levin et al., 2021 ; Rosenberg et al., 2022). Sin embargo, la frecuencia de los refuerzos necesarios (si los hay) en diferentes grupos de edad no está clara y los beneficios absolutos pueden ser mucho mayores entre las personas inmunodeprimidas y de edad avanzada, dado el gradiente de edad muy pronunciado de la tasa de mortalidad por infección por COVID-19 ( Axfors and Ioannidis, 2022 ). Además, con nuevas variantes emergentes como Omicron, se cuestiona la capacidad de lograr una protección suficiente contra la infección y la transmisión ( Buchan et al., 2022 ). En el contexto de estrategias de vacunación y medidas generales cada vez más complejas contra la COVID-19, la inmunidad natural adquirida después de las infecciones por SARS-CoV-2 puede ser un factor crucial, aunque a menudo menos considerado ( Ioannidis, 2020b ; McIntyre et al., 2022 ).
El conocimiento detallado sobre la eficacia y la duración de la inmunidad natural en términos de protección contra las reinfecciones y la morbi-mortalidad asociadas a las mismas, puede ser clave en la pandemia de COVID-19, ya que es posible que más de un tercio y posiblemente más de la mitad de la población mundial ya esté infectada (al menos una vez) con SARS-CoV-2 a principios de 2022, y la mayoría de los casos no se detectaron ni informaron oficialmente ( Bergeri et al., 2021 ; Hotez et al., 2021 ; McIntyre et al., 2022). Esta estimación se basa en datos de seroprevalencia que sugieren que casi una cuarta parte de la población mundial se infectó en la primavera de 2021 con un aumento adicional sustancial a partir de entonces con el advenimiento de las olas de la variante Delta desde mediados de 2021 y luego las oleadas masivas de la variante Omicron que comenzaron en Diciembre de 2021 ( Arora et al., 2021 ; Bergeri et al., 2021 ; Chen et al., 2021 ; Ioannidis, 2021c ; Jones et al., 2021). Si bien los países de altos ingresos con grandes esfuerzos en la realización de pruebas son capaces de detectar e informar sobre cada secundario de SARS-CoV-2 actualmente, la proporción entre casos reales y casos informados parece haber sido de aproximadamente 62 a 1 en países de bajos ingresos en una revisión sistemática que incluye datos hasta octubre de 2021 ( Bergeri et al., 2021 ). Es probable que esta proporción haya disminuido con el tiempo incluso en países de bajos ingresos, ya que se realizan más pruebas, pero es probable que las proporciones superiores a 10 sean comunes en estos países. Por ejemplo, en la India, la encuesta serológica nacional de agosto de 2021 mostró una seroprevalencia de casi el 70 %, mientras que los casos documentados fueron solo de alrededor del 2 % ( Jahan et al., 2021). Por lo tanto, los casos asintomáticos no reconocidos son muy comunes. Un metaanálisis reciente informó que incluso entre los pacientes con COVID-19 confirmado, el 40,5 % eran asintomáticos ( Ma et al., 2021 ). Con el advenimiento de la variante Omicron, la proporción de casos completamente asintomáticos puede ser aún mayor. Dado que Omicron muestra una transmisibilidad aún mayor y olas epidémicas pronunciadas, es probable que la proporción de personas infectadas aumente sustancialmente ( Christie, 2021 ; Del Rio et al., 2022 ; Kupferschmidt y Vogel, 2021 ). A medida que la pandemia está entrando en su fase endémica, pronto puede ser una excepción poco común que una persona no haya sido infectada con SARS-CoV-2 al menos una vez.
El alcance de esta revisión narrativa es proporcionar una breve descripción del conocimiento actual sobre la eficacia y la duración de la inmunidad natural derivada de grandes estudios epidemiológicos en poblaciones generales, preferiblemente encuestas nacionales. En esta revisión también se tratan las comparaciones de la inmunidad natural frente a la inmunidad inducida por la vacuna y la llamada inmunidad híbrida, es decir, la inmunidad lograda por la infección por SARS-CoV-2 más la vacunación. Nuestro trabajo se basa en una búsqueda bibliográfica en PubMed hasta el 1 de enero de 2022 utilizando los términos de búsqueda "SARS-CoV-2" o "COVID-19" en combinación con "reinfección" (que arroja 891 artículos). Este procedimiento de búsqueda se reiteró en medRxiv, pero solo se incluyeron artículos de gran interés (con la debida precaución) de estos preprints no revisados por pares. Nuestro trabajo amplía y actualiza significativamente revisiones anteriores sobre este tema (Kojima et al., 2021 ; Petras, 2021 ; Shenai et al., 2021 ). Si bien este manuscrito se enfoca en datos epidemiológicos relacionados con la inmunidad natural, remitimos al lector a excelentes revisiones sobre las respuestas inmunológicas detalladas a las infecciones y vacunas por SARS-CoV-2, ya que solo abordamos brevemente estos temas en algunas secciones de nuestra revisión ( Castro Dopico et al., 2022 ; Cromer et al., 2021 ; Gussarow et al., 2021 ; Milne et al., 2021 ).
2 . Eficacia y duración de la inmunidad natural frente a reinfecciones
La diferenciación entre la reinfección verdadera y la infección primaria prolongada por SARS-CoV-2 supone un desafío debido a los informes de diseminación viral que duran varias semanas o algunos meses ( Lee et al., 2021 ; Long et al., 2021 ; Yahav et al., 2021 ). Para fines epidemiológicos, una reinfección por SARS-CoV-2 podría definirse como cualquier prueba de RT-PCR positiva más allá de 90 días tras un resultado inicial positivo de la prueba, una definición que ha sido adoptada por muchos científicos y organizaciones, incluidos los Centros para el Control de Enfermedades (CDC) en los Estados Unidos ( Yahav et al., 2021). Por supuesto, sería óptimo tener resultados negativos en las pruebas de PCR después del diagnóstico inicial y confirmar las reinfecciones en función de los resultados de la secuenciación que documentan diferentes cepas virales, pero este enfoque generalmente no es factible para encuestas grandes. En general, los datos epidemiológicos sobre la inmunidad natural deben, por supuesto, interpretarse a la luz de las diversas fuentes potenciales de sesgos de estos estudios observacionales. Estos sesgos incluyen, pero no se limitan a:
- 1.
Sesgo de detección debido a las diferentes frecuencias de prueba entre los previamente infectados y los no infectados previamente, y también entre los individuos vacunados y no vacunados.
- 2.
Clasificaciones erróneas debido a infecciones no reconocidas (tanto primarias como reinfecciones).
- 3.
Clasificación errónea debido a la sensibilidad y especificidad imperfectas de las pruebas moleculares y de anticuerpos.
- 4.
Confusión debida a varios factores que pueden diferir entre individuos infectados y no infectados y que también pueden afectar la posibilidad de volver a infectarse y tener un resultado grave después de la reinfección, por ejemplo, grado de protección y grado de riesgo/exposición (debido a diferentes conciencia y posible sensación de protección dada una infección previa), diferente aceptación de las vacunas, diferencias en las comorbilidades, en la demografía, en la ocupación, en el estado socioeconómico, vivir en entornos institucionalizados y potencialmente muchos otros factores que pueden ser difíciles de medir o incluso son completamente desconocido.
Estas consideraciones se aplican a todas las secciones de esta revisión. Por lo tanto, las estimaciones de incertidumbre (p. ej., intervalos de confianza (IC) del 95 %) derivadas de los estudios de reinfección y que se presentan a continuación deben considerarse muy conservadoras. El sesgo también puede afectar las propias estimaciones y la dirección del impacto puede no ser necesariamente predecible. Además, las estimaciones pueden ser diferentes con variantes nuevas y emergentes y en condiciones con diferentes estrategias de vacunación y aceptación de la vacuna.
2.1 . Eficacia de la inmunidad natural
La primera evidencia sobre la inmunidad natural derivada de una cohorte poblacional fue reportada por un estudio en 133,266 pacientes previamente infectados por SARS-CoV-2 de Qatar que mostró que el riesgo de reinfección se estimó en 0.02% (IC 95%: 0.01%–0.02%), y que la tasa de incidencia de reinfección por 10 000 personas por semana fue de 0,36 (IC del 95 %: 0,28 a 0,57) ( Abu-Raddad et al., 2021e ). Ese estudio no incluyó una comparación de grupo formal con personas no infectadas anteriormente, pero estimó, según el modelo de la tasa de incidencia general en Qatar, que la eficacia de la infección natural por SARS-CoV-2 contra la reinfección es de aproximadamente el 95%. A finales de 2020 y principios de 2021, los primeros estudios de cohortes en poblaciones específicas documentaron una reducción significativa del riesgo de infecciones por SARS-CoV-2 en pacientes con infección previa versus sin infección previa (Breathnach et al., 2021b ; Hall et al., 2021 ; Hanrath et al., 2021 ; Kojima et al., 2021 ; Lumley et al., 2021a ). Lumley et al. publicó una de las primeras investigaciones sobre este tema en una cohorte de 12 541 trabajadores de la salud, que estaban bien diagnosticados mediante PCR y pruebas de anticuerpos ( Lumley et al., 2021a ). Informaron que una infección previa por SARS-CoV-2 se asoció con una protección del 89 % (IC del 95 %: 44 %–97 %) contra la reinfección en comparación con personas que no estaban infectadas previamente ( Lumley et al., 2021a)). Las primeras encuestas nacionales que abordaron este tema fueron de Austria y Dinamarca, acompañadas de un gran estudio de cohorte de los Estados Unidos que se basó en datos de seroprevalencia ( Hansen et al., 2021 ; Harvey et al., 2021 ; Pilz et al., 2021 ). Este último estudio incluyó a 3 257 478 participantes y mostró una reducción del 90 % (IC del 95 %: 81 %–95 %) de las infecciones por SARS-CoV-2 al comparar pacientes con una prueba de anticuerpos positiva frente a una negativa contra el SARS-CoV-2 ( Harvey et al. ., 2021 ). De acuerdo con esto, los datos de una encuesta basada en la población en 192 984 personas con resultados de pruebas de anticuerpos contra el SARS-CoV-2 disponibles de Qatar mostraron una eficacia del 95,2 % (IC del 95 %: 94,1 %–96,0 %) de la inmunidad natural basada en el estado de los anticuerpos ( Abu Raddad et al., 2021d). Los estudios adicionales en la población general sobre este tema se derivaron de datos de salud nacional de Qatar, grandes estudios de cohortes en los Estados Unidos y encuestas basadas en la población de Italia y el Reino Unido, y se enumeran en la Tabla 1 que se limita a estudios basados en la población que proporcionan comparaciones de grupos para el riesgo de infección en individuos con y sin infecciones previas por PCR confirmadas por SARS-CoV-2 ( Abu-Raddad et al., 2021a ; Abu-Raddad et al., 2021e ; Chemaitelly et al., 2021a ; Goldberg et al., 2021c ; Kim et al., 2021 ; Sheehan et al., 2021 ; Spicer et al., 2021). En resumen, todos estos estudios epidemiológicos han documentado consistentemente que una infección previa por SARS-CoV-2 confiere una protección sustancialmente grande contra las reinfecciones.
Todos los estudios de la Tabla 1 son estudios revisados por pares basados en casos confirmados por PCR al inicio y en el seguimiento, con la excepción de un estudio de los Estados Unidos que incluye pruebas de antígeno además de las pruebas de PCR, y el estudio del Reino Unido que clasificó el estado de infección al inicio del estudio en PCR o pruebas de anticuerpos ( Breathnach et al., 2021b ; Spicer et al., 2021 ). Es importante destacar que los estudios enumerados en la Tabla 1 cubren diferentes oleadas de infección, incluida también la variante Delta, pero no hay datos sobre la variante Omicron. Los datos preliminares sugieren que la variante Omicron posee una capacidad sustancial para evadir la inmunidad de una infección previa, en contraste con las variantes Beta o Delta ( Lusvarghi et al., 2021 ;Rössler et al., 2021 , Danza et al., 2022 ). Por lo tanto, la inmunidad natural debe reevaluarse después de la incorporación de más datos de infecciones por variantes Omicron del SARS-CoV-2. En este contexto, un artículo preliminar que informa datos nacionales de Qatar sugiere que, si bien la protección contra las reinfecciones puede reducirse para Omicron al 56,0 % (IC del 95 %: 50,6 %–60,9 %), la protección contra la hospitalización o la muerte debido a las reinfecciones parece igualmente alta en cuanto a otras variantes con un 87,8% (IC 95%: 47,5%-97,1%) ( Altarawneh et al., 2022 ). Sin embargo, los informes preliminares sobre la inmunidad natural con respecto a Omicron son inconsistentes y requieren una interpretación cautelosa ( Eggink et al., 2021 ; Pulliam et al., 2021 ). Mientras que la Tabla 1 se limita a estudios en poblaciones generales que incluyen estimaciones de riesgo relativo de infecciones con SARS-CoV-2 en grupos con y sin infecciones previas, hay muchos otros estudios sobre este tema en poblaciones específicas (por ejemplo, trabajadores de la salud) o con otros diseños de estudio (por ejemplo, basado únicamente en anticuerpos con una fecha de infección poco clara o grupos de control faltantes) que están en línea con la noción de que la inmunidad natural protege significativamente contra las reinfecciones ( Abrokwa et al., 2021 ; Fabianova et al., 2021 ; Hall et al. , 2021 ; Hanrath et al., 2021 ; Harvey et al., 2021 ; Iversen et al., 2021 ; Jeffery-Smith et al., 2021 ;Kojima et al., 2021 ; Leidi et al., 2021 ; Letizia et al., 2021 ; O Murchu et al., 2021 ; Rennert y McMahan, 2021 ).
Se han utilizado varios enfoques metodológicos para evaluar la eficacia de la inmunidad natural. Una nota especial puede valer la pena para el diseño de estudio con prueba negativa ( Ayoub et al., 2022 ). En este diseño, los casos y los controles negativos de la prueba emparejados se seleccionan entre las personas que se presentan para la prueba debido a los síntomas. La efectividad de la infección previa para prevenir reinfecciones se calcula como uno menos la proporción de probabilidades de infección previa en individuos con resultados positivos, a las probabilidades de infección previa en individuos con resultados negativos para la infección. Para advertencias sobre la solidez del diseño de prueba negativa, consulte Lewnard et al., (2021) .
2.2 . Duración de la inmunidad natural
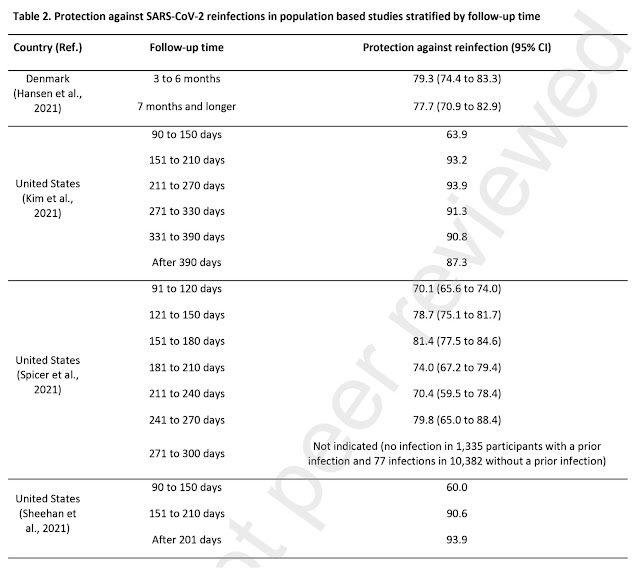
Varios estudios indican que la inmunidad natural parece ser relativamente duradera ( Chemaitelly et al., 2021a ; Flacco et al., 2021 ; Hansen et al., 2021 ; Leidi et al., 2021 ; Peghin et al., 2021 ; Pilz et al., 2021 ; Salehi-Vaziri et al., 2021 ; Sheehan et al., 2021 ; Vitale et al., 2021 ). En detalle, la encuesta nacional en Dinamarca no encontró ninguna evidencia de que la protección contra las reinfecciones estuviera disminuyendo después de 6 meses, un hallazgo que es consistente con los datos de Austria ( Hansen et al., 2021 ; Pilz et al., 2021). Curiosamente, algunas investigaciones indican que la protección contra la reinfección es más baja entre 4 y 5 meses después de la infección inicial y aumenta a partir de entonces, un hallazgo que hipotéticamente podría explicarse por la diseminación viral persistente, es decir, la clasificación errónea de las infecciones prolongadas por SARS-CoV-2 como reinfecciones ( Kim et al. al., 2021 ; Sheehan et al., 2021 ). Algunos estudios poblacionales con tiempos de seguimiento superiores a un año informaron una eficacia sostenida de protección contra las reinfecciones por SARS-CoV sin una disminución significativa al final del período de observación ( Flacco et al., 2021 ; Kim et al., 2021 ). En este contexto, Kim et al. mostró que más de 390 días después de la infección inicial por SARS-CoV-2, la protección contra cualquier infección fue del 87,3 % y contra la infección sintomática del 95,0 % ( Kim et al., 2021 ). En la Tabla 2 se muestran datos detallados sobre estudios de base poblacional, estratificados por diferentes períodos de seguimiento, que arrojaron información sobre la eficacia de la protección contra la reinfección.
Sin embargo, los datos preliminares de Israel, que carecen de una comparación con las personas no infectadas y no vacunadas, sugieren que la protección contra las reinfecciones puede disminuir de 6 a más de 12 meses después de la primera infección por SARS-CoV-2 ( Goldberg et al., 2021a ). En detalle, las reinfecciones (IC del 95 %) por 100 000 días-persona fueron de 10,5 (8,8 a 12,4) entre los 4 y los 6 meses y aumentaron a 30,2 (28,5 a 32,0) después de más de 12 meses después de la primera infección ( Goldberg et al., 2021a ) . Aun así, la tasa se mantiene baja después de más de 12 meses en términos de riesgo absoluto (menos del 0,1% mensual).
En conjunto, los estudios epidemiológicos indican que la protección contra las reinfecciones por la inmunidad natural dura más de un año con una disminución moderada, si es que la hay, durante este período. La noción de protección a largo plazo contra las reinfecciones también está respaldada por datos sobre la persistencia de los anticuerpos contra el SARS-CoV-2 y la inmunidad celular durante más de un año en la mayoría de los pacientes ( Chellamuthu et al., 2021 ; Dehgani-Mobaraki et al. al., 2021 ; Gussarow et al., 2021 ; Lau et al., 2021 ; Rosati et al., 2021 ).
2.3 . Factores de riesgo de reinfecciones
Los datos sobre los factores de riesgo que identifican a los grupos con mayor riesgo de reinfecciones por SARS-CoV-2 son menos claros. Algunos informes indican que las personas mayores, en particular las que se encuentran en centros de atención a largo plazo, los pacientes inmunocomprometidos y aquellos con ciertas comorbilidades o riesgo de exposición (por ejemplo, trabajadores de la salud) pueden tener tasas más altas de reinfecciones, pero los datos siguen siendo inconsistentes ( Fakhroo et al. , 2021 ; Hansen et al., 2021 ; Murillo-Zamora et al., 2021a , 2021b ; Ringlander et al., 2021 ; Spicer et al., 2021). Es plausible que el riesgo de reinfección sea una función del riesgo de exposición. Con más exposiciones a medida que las sociedades usan menos o ninguna medida de bloqueo y los ciudadanos se sienten más seguros para exponerse, pueden producirse tasas más altas de reinfecciones ( Ioannidis, 2021a ). Sin embargo, la forma exacta de la función de riesgo de exposición-reinfección (por ejemplo, si hay una meseta y muchas personas no se reinfectarán independientemente de la cantidad de exposición aumentada) aún se desconoce. Además, la diferenciación entre COVID-19 persistente y reinfección es un desafío, en particular en personas mayores ( Ringlander et al., 2021 ). Tampoco está del todo claro si la gravedad de la enfermedad de la infección inicial por SARS-CoV-2 modifica significativamente el riesgo de reinfecciones, pero cabe señalar que incluso las infecciones asintomáticas por SARS-CoV-2 provocan una fuerte respuesta inmunológica ( Boyton y Altmann, 2021 ). ; Garrido et al., 2021 ; Murillo-Zamora et al., 2021a ; Schuler et al., 2021 ; Spicer et al., 2021 ).
No está claro si la determinación de anticuerpos anti SARS-CoV-2 en pacientes con infección previa conocida es útil para la estratificación del riesgo de reinfecciones. Un estudio retrospectivo del Reino Unido mostró que un grupo de 224 pacientes previamente infectados con SARS-CoV-2 que no tenían anticuerpos detectables contra el SARS-CoV-2, aún tenían una protección del 80 % (IC del 95 %: 19 %–95 %). frente a infecciones por SARS-CoV-2 en comparación con un grupo de personas sin infección previa y serología negativa ( Breathnach et al., 2021a ). En el mismo estudio, el riesgo de reinfección no fue significativamente diferente en pacientes con una infección previa por SARS-CoV-2, cuando se compararon grupos con anticuerpos contra el SARS-CoV-2 detectables versus sin ellos ( Breathnach et al., 2021a ). Este hallazgo no cuestiona los numerosos estudios que muestran que los participantes con anticuerpos contra el SARS-CoV-2 detectables frente a los que no los tienen tienen un riesgo significativamente menor de infecciones, sino que simplemente cuestiona el valor pronóstico adicional de las mediciones de anticuerpos en pacientes recuperados ( Harvey et al., 2021 ). Se agradecerían más estudios sobre este tema, pero la adopción de pruebas de anticuerpos en las pautas para la atención personalizada individual sería precaria o incluso dañina según lo que sabemos actualmente. En principio, agregar pruebas masivas de anticuerpos para uso clínico puede complicar un entorno ya complejo en el que se realizan pruebas masivas para pruebas virales. Esto puede crear más confusión y prolongar la percepción de una anomalía en curso en la población.
Otros aspectos de la respuesta inmune también pueden estar modificando el riesgo de reinfección. Además de los anticuerpos, las infecciones por SARS-CoV-2 provocan fuertes respuestas inmunitarias celulares ( Havervall et al., 2022 ; Melenotte et al., 2020 ; Sekine et al., 2020 ). El impacto de los diferentes tipos de respuesta inmunitaria celular, por ejemplo, la respuesta Th1 versus Th2 en la modulación del riesgo de reinfección, necesita un mejor estudio ( Melenotte et al., 2020 ).
2.4 . Gravedad clínica de las reinfecciones
Una pregunta aún más crucial es si la inmunidad natural conferida por una infección previa por SARS-CoV-2 puede mitigar la gravedad de la enfermedad ante una posible reinfección. Mediante el uso de bases de datos federadas nacionales de Qatar, se demostró en un estudio de poblacional de casos y controles bien emparejados, que las reinfecciones con SARS-CoV-2 tenían un 90 % menos de probabilidades (95 % IC: 75 %–97 %) de resultar en hospitalización o muerte en comparación con las infecciones primarias ( Abu-Raddad et al., 2021c ).
Las comparaciones de la gravedad de la enfermedad para cada paciente individual durante el primer episodio versus el episodio de reinfección también se han evaluado en varias series de casos y estudios de cohortes pequeños y han indicado de manera parcial, pero no consistente, que las reinfecciones son menos graves que las infecciones primarias ( Abu-Raddad et al. ., 2021e ; Fabianova et al., 2021 ; Hussein et al., 2021 ; Lo Muzio et al., 2021 ; Qureshi et al., 2022 ; Slezak et al., 2021). En conjunto, se acumula evidencia de que las reinfecciones pueden ser significativamente menos graves que las infecciones primarias, un hallazgo con enormes implicaciones para la pandemia de COVID-19 y su evolución hacia una fase endémica. Por supuesto, la gravedad clínica reducida de las reinfecciones también tiene sentido desde un punto de vista biológico, ya que un sistema inmunitario previamente preparado debería estar mejor preparado para un nuevo desafío con este virus ( Boyton y Altmann, 2021 ; Castro Dopico et al., 2022 ; Cromer et al., 2021 ; Milne et al., 2021 ).
Dado que las reinfecciones, en comparación con las primo-infecciones, están asociadas con una carga viral significativamente más baja, como lo demuestra el valor del umbral del ciclo (Ct) de RT-qPCR, pueden ser menos infecciosas y, por lo tanto, pueden estar asociadas con una transmisión reducida ( Abu -Raddad et al., 2022 ). Esto puede tener implicaciones significativas para el curso de las olas epidémicas de COVID-19 ( Abu-Raddad et al., 2022 ). También se debe tener en cuenta que las reinfecciones experimentales en humanos con coronavirus humanos endémicos mostraron síntomas más leves y una duración más corta en comparación con las infecciones primarias ( Callow et al., 1990 ; Lavine et al., 2021 ). Las infecciones primarias con los cuatro coronavirus humanos endémicos ocurren temprano en la vida a una edad promedio de entre 3,4 y 5,1 años, con reinfecciones frecuentes pero leves más adelante en la vida ( Lavine et al., 2021 ). Se especula si, una vez alcanzada la fase endémica, un patrón similar podría aplicarse también al SARS-CoV-2 ( Lavine et al., 2021 ).
También habría que considerar que la comparación de la gravedad entre las infecciones primarias y las reinfecciones excluye las infecciones primarias más graves que provocaron la muerte. Además, el perfil de salud y las comorbilidades de una misma persona pueden diferir en el momento de la reinfección frente al momento de la infección primaria. Esto puede ser más relevante muchos años después de la fase endémica, por ejemplo, cuando la reinfección afecta a una persona que es varios años mayor y puede haber desarrollado varios problemas de salud en el ínterin en comparación con cuando tuvo la infección primaria.
3 . Comparación de la inmunidad natural con la inducida por vacunas y la inmunidad híbrida
3.1 . Inmunidad inducida por vacunas
La alta eficacia de las vacunas contra el SARS-CoV-2, por ejemplo, 94,1 % para la vacuna mRNA-1273 (Moderna) y 95 % para la vacuna BNT162b2 (BioNTech/Pfizer), ya se ha revisado y resumido en otro lugar ( Rotshild et al., 2021). ; Sharif et al., 2021 ). En resumen, los ECA sobre vacunas contra el SARS-CoV2 evaluaron períodos de tiempo inferiores a 4 meses y su muy alta eficacia a corto plazo se ha confirmado posteriormente en estudios de efectividad en entornos del mundo real ( Baden et al., 2021 ; Chemaitelly et al., 2021b ; Polack et al., 2020 ; Rosenberg et al., 2022). Sin embargo, extender los períodos de observación con respecto a estas vacunas a aproximadamente 6 meses y más produjo una disminución significativa de la protección contra las infecciones por SARS-CoV-2 ( Chemaitelly et al., 2021b ; Goldberg et al., 2021b ; Rosenberg et al., 2022 ). En detalle, se observó una disminución de la eficacia con respecto a la protección contra las infecciones por SARS-CoV-2 (p. ej., solo aproximadamente el 20 % después de aproximadamente medio año en Qatar), mientras que la protección contra la enfermedad grave se mantuvo o mostró solo una disminución moderada ( Chemaitelly et al. al., 2021b ; Goldberg et al., 2021b ; Rosenberg et al., 2022). Los datos nacionales de Israel mostraron que en las personas que recibieron dos dosis de la vacuna BNT162b2 al menos 5 meses antes, una dosis adicional de la vacuna, el llamado refuerzo, redujo significativamente la mortalidad y la enfermedad grave ( Arbel et al., 2021 ; Bar-On et al., 2021a ). Estos hallazgos sugieren que este refuerzo restauró y probablemente superó la eficacia inicial a corto plazo después de la vacunación inicial. Todavía están surgiendo datos a partir de este escrito con respecto a la eficacia y la efectividad de los refuerzos contra las variantes de Omicron. Los datos preliminares sugieren una capacidad mucho menor para restaurar la protección contra la infección y la vacunación ( Altarawneh et al., 2022 ; Buchan et al., 2022 ; Lyngse et al., 2021 ;Pulliam et al., 2021 ). Sin embargo, las muertes y las hospitalizaciones siguen siendo claramente bajas ( Christie, 2021 ; Kupferschmidt y Vogel, 2021 ; Ulloa et al., 2022 ).
3.2 . Inmunidad natural frente a inmunidad inducida por vacunas
Las comparaciones de inmunidad natural versus inmunidad inducida por vacunas están restringidas a estudios observacionales con todas sus limitaciones inherentes, como se discutió en la sección 2 anterior ( Bozio et al., 2021 ; Gazit et al., 2021 ; Goldberg et al., 2021a , 2021c ; Lumley et al., 2021b ; Satwik et al., 2021 ; Shenai et al., 2021 ; Shrestha et al., 2021). Los sesgos pueden ser aún más prominentes en estas comparaciones, ya que combinan los sesgos de las comparaciones entre infectados y no infectados, más los que afectan a las comparaciones entre vacunados y no vacunados, con potenciales fuertes sesgos de selección y confusión. De particular interés, la proporción de personas previamente infectadas y/o vacunadas puede influir en las estimaciones de efectividad. Por ejemplo, si hipotetizamos, con fines ilustrativos, que la infección previa confiere una protección perfecta contra la muerte por reinfección y toda la población ha sido previamente infectada, entonces una vacuna mostrará una efectividad cero, porque no hay espacio para mejorar más la protección. De manera similar, si todas las personas de una población están vacunadas y la vacunación brinda una protección perfecta contra la muerte, entonces la reinfección después de la vacunación parecerá ofrecer cero beneficios adicionales para los resultados de muerte.
Una revisión sistemática anterior y análisis combinados de Shenai et al. concluyó que la inmunidad natural es al menos equivalente a la protección brindada por la vacunación "completa" contra el SARS-CoV-2 (sin refuerzo), pero se han publicado estudios adicionales después de la búsqueda bibliográfica de esta excelente revisión (31 de agosto de 2021) ( Bozio et al., 2021 ; Goldberg et al., 2021a ; Shenai et al., 2021). En particular, los datos de los ECA de vacunas sobre el estado de infección previa por SARS-CoV-2 proporcionaron solo muy pocos casos, lo que impidió los análisis estadísticos con un poder estadístico adecuado que compararan pacientes previamente infectados y no vacunados versus participantes previamente no infectados y vacunados (es decir, 0.014 versus 0.024 infecciones por persona año) y, de todos modos, la comparación no sería aleatoria ( Shenai et al., 2021 ).
Tres encuestas a nivel nacional (todas preimpresas a partir de este escrito) de Israel con una población general estudiada de aproximadamente 6 millones de participantes realizaron, entre otros, una comparación entre la inmunidad adquirida después de la infección por SARS-CoV-2 y la inmunidad inducida por la vacunación BNT162b2 ( Gazit et al., 2021 ; Goldberg et al., 2021a , 2021c ). Goldberg et al. compararon pacientes no vacunados con una infección previa por SARS-CoV-2 e individuos vacunados seguidos desde una semana después de la segunda dosis de la vacuna en adelante versus un grupo de individuos no vacunados y no infectados previamente ( Goldberg et al., 2021c) . El tiempo de seguimiento fue desde el 20 de diciembre de 2020 (es decir, la fecha de lanzamiento del programa de vacunación) hasta el 20 de marzo de 2021, para todos los grupos, pero solo se incluyeron en el grupo los pacientes con una infección previa que ocurrió del 1 de junio al 20 de septiembre de 2020, grupo de inmunidad natural, ya que las reinfecciones solo se diagnosticaban cuando ocurrían tres meses o más después del primer diagnóstico de infección. En comparación con los individuos no vacunados y no infectados previamente, el grupo de inmunidad natural y vacunados tuvo una protección similar del 94,8 % y 92,8 % contra la infección, del 94,1 % y 94,2 % contra la hospitalización, y del 96,4 % y 94,4 % contra la enfermedad grave, respectivamente ( Goldberg et al., 2021c ). Gazit et al. realizó una investigación similar en Israel durante el período de seguimiento del 1 de junio al 14 de agosto de 2021 (Gazit et al., 2021 ). Compararon las personas que recibieron su segunda dosis de vacuna antes del 28 de febrero de 2021 con pacientes que tenían una infección documentada con SARS-CoV-2 del 1 de enero al 28 de febrero de 2021, de modo que ambos grupos tuvieron tiempos de seguimiento similares ( Gazit et al. al., 2021). Después de ajustar por comorbilidades, el grupo vacunado versus el previamente infectado tenía un riesgo 13 (IC 95%: 8 a 21) veces mayor de infecciones por SARS-CoV-2 y un riesgo 27 (IC 95%: 13 a 58) veces mayor de enfermedad sintomática. La reiteración de estos análisis mediante la inclusión de todos los pacientes con infecciones documentadas por SARS-CoV-2 desde el 1 de marzo de 2020 hasta el 28 de febrero de 2021 en el grupo previamente infectado resultó en un aumento del riesgo de infecciones de 6,0 veces (IC del 95 %: 4,9 a 7,3) y 7,1 (IC del 95 %: 5,5 a 9,2) veces más riesgo de enfermedad sintomática en el grupo vacunado frente al previamente infectado, lo que sugiere una disminución de la inmunidad natural con el tiempo ( Gazit et al., 2021). Finalmente, Goldberg et al. evaluaron las infecciones por SARS-CoV-2 en Israel durante el período de estudio del 1 de agosto al 30 de septiembre de 2021 estratificando sus análisis según el último evento inductor de inmunidad, es decir, la última vacunación o infección por SARS-CoV-2 ( Goldberg et al. , 2021a). La protección contra la infección por SARS-CoV-2 fue significativamente mayor en los individuos recuperados frente a los vacunados cuando se evaluó un período de tiempo similar desde el último evento inductor de inmunidad. En los análisis ajustados por edad, sexo, grupo de población y riesgo de exposición, los casos de infección por 100.000 días-persona (con un IC del 95 %) para los pacientes recuperados fueron 10,5 (8,8 a 12,4) a los 4 a 6 meses (después de la infección) y 30,2 (28,5 a 32,0) a más de 12 meses. Los resultados respectivos para individuos vacunados fueron 21,1 (20,0 a 22,4) a menos de 2 meses (después de la vacunación), 69,2 (68,8 a 69,8) a los 4 a 6 meses y 88,9 (88,3 a 89,6) a los 6 a 8 meses ( Goldberg et al. al., 2021a). Es importante destacar que después de recibir un refuerzo (es decir, una dosis de vacuna adicional) en el grupo vacunado, la tasa de infección respectiva se redujo a 8,2 (8,0 a 8,5) cuando el tiempo transcurrido desde el refuerzo fue inferior a 2 meses.
Además de los datos nacionales de Israel, existen otras investigaciones sobre este tema, pero con un número significativamente menor de participantes y con una generalización limitada debido a la naturaleza de sus cohortes de estudio tan específicas que se desvían de la población general ( Bozio et al., 2021 ; Satwik et al., 2021 ). En un estudio observacional entre 4296 empleados de un hospital de atención terciaria en la India, dos dosis de la vacuna ChAdOx1 (AstraZeneca) mostraron una eficacia de protección (con un IC del 95 %) frente a personas no vacunadas del 28 % (10 % a 41 %) contra la enfermedad sintomática por infección por SARS-CoV-2, del 67% (44% a 81%) contra la enfermedad moderada a severa y del 76% (37% a 89%) contra la necesidad de suministro de oxígeno ( Satwik et al., 2021). Es importante destacar que la eficacia respectiva para la infección previa por SARS-CoV-2 versus ninguna infección fue del 93 % (87 % a 96 %) contra la infección sintomática por SARS-CoV-2, 89 % (57 % a 97 %) contra la enfermedad moderada a grave, y 85% (−9% a 98%) contra la necesidad de suministro de oxígeno ( Satwik et al., 2021 ). Lumley et al. observó que en 13 109 trabajadores de la salud, dos dosis de vacunas (BNT126b2 o ChAdOx1) redujeron las infecciones por SARS-CoV-2 en un 90 % (IC del 95 %: 62 %–98 %) y la seropositividad (es decir, un indicador de una infección previa) en un 85 % (IC del 95 %: 74 %–92 %) ( Lumley et al., 2021b). En un estudio entre 52 238 trabajadores de la salud de los Estados Unidos, no se produjo ninguna infección por SARS-CoV-2 en 1359 participantes con infección previa que permanecieron sin vacunar durante el seguimiento que duró una mediana de 143 días (rango intercuartílico de 76 a 179 días) para todos los participantes previamente infectados ( Shrestha et al., 2021 ). En el mismo estudio, solo ocurrieron 15 infecciones (0,7 %) en participantes que no estaban previamente infectados pero vacunados ( Shrestha et al., 2021). En otro estudio de los Estados Unidos, se examinó a pacientes hospitalizados con una enfermedad similar a la COVID-19 para evaluar si las probabilidades de tener un resultado positivo en la prueba del SARS-CoV-2 difieren en pacientes que entre 90 y 179 días antes de la hospitalización recibieron dos dosis de una vacuna de ARNm SARS-CoV-2 o tenía una infección previa por SARS-CoV-2 ( Bozio et al., 2021). Los criterios de inclusión adicionales fueron, entre otros, al menos una prueba de SARS-CoV-2 ≥14 días antes de la hospitalización, la disponibilidad de vacunas y la prueba de SARS-CoV-2 durante la hospitalización, de modo que solo 7348 de 201,269 pacientes que fueron hospitalizados por COVID -19 enfermedades del 1 de enero al 2 de septiembre de 2021 fueron elegibles para el análisis, lo que sugiere un riesgo de fuerte sesgo de selección y baja generalización. La infección por SARS-CoV-2 confirmada por laboratorio se detectó en 324 (5,1 %) de los 6328 pacientes vacunados y en 89 (8,7 %) de los pacientes no vacunados previamente infectados. La razón de probabilidad ajustada (IC del 95 %) de infección por SARS-CoV-2 confirmada por laboratorio en el grupo previamente infectado frente al grupo vacunado fue de 5,5 (2,8 a 11,0) ( Bozio et al., 2021 ).
En conjunto, los estudios observacionales indican que la inmunidad natural ofrece una protección igual o mayor contra las infecciones por SARS-CoV-2 en comparación con las personas que reciben dos dosis de una vacuna de ARNm, pero los datos no son totalmente consistentes. Sería fundamental para cualquier análisis tener en cuenta el momento del último evento inductor de inmunidad (es decir, el momento de la infección y la vacunación), ya que existe evidencia convincente de una disminución relativamente rápida de la protección contra las infecciones por SARS-CoV-2 mediante la vacunación mientras la disminución de la protección inducida por la inmunidad natural por infección previa parece ser relativamente moderada. Es muy difícil ajustar todas las diferencias de individuos vacunados y previamente infectados y los resultados de tales análisis pueden depender sustancialmente de cómo se seleccione/filtre la población de estudio y qué ajustes específicos se realicen.
3.3 . Inmunidad híbrida
El término inmunidad híbrida se aplica a las personas con una infección previa por SARS-CoV-2 que luego fueron vacunadas contra el SARS-CoV-2 o viceversa ( Abu-Raddad et al., 2021b ; Bates et al., 2021 ; Cavanaugh et al. , 2021 ; Gazit et al., 2021 ; Goldberg et al., 2021a ; Kim et al., 2021 ; Kojima et al., 2021 ; Lumley et al., 2021b ; Satwik et al., 2021 ; Shenai et al., 2021 Shrestha et al., 2021). Los datos sobre la inmunidad híbrida de los ECA de la vacuna contra el SARS-CoV-2 fueron limitados debido al pequeño número de participantes previamente infectados por el SARS-CoV-2 cuando se realizaron estos estudios, lo que impidió realizar análisis estadísticos precisos sobre este tema ( Shenai et al., 2021 ). Sin embargo, para los ECA realizados actualmente y para los que puedan realizarse en el futuro, será esencial considerar la infección previa y la inmunidad híbrida.
En la investigación nacional en más de 5,7 millones de residentes de Israel que ya se mencionó anteriormente, se demostró que cuando el tiempo transcurrido desde el último evento que confiere inmunidad (ya sea infección primaria o vacunación) era el mismo, las tasas de infección por SARS-CoV- 2 fueron similares en los siguientes grupos: (a) individuos que tenían una infección previa y no estaban vacunados, (b) individuos que tenían una infección y luego fueron vacunados con una dosis única después de al menos 3 meses y (c) individuos que estaban vacunados (dos dosis) y luego infectados ( Goldberg et al., 2021a). En detalle, de 4 a 6 meses después del último evento que confiere inmunidad, las tasas ajustadas de infecciones por SARS-CoV-2 (IC del 95 %) por 100 000 días en riesgo fueron (a) 10,5 (8,8 a 12,4), (b) 10,3 (9,4 a 11,4), y (c) 12,8 (9,9 a 16,6), respectivamente. Todos estos últimos grupos mostraron una disminución de la inmunidad con el tiempo y tenían tasas de infección por SARS-CoV-2 significativamente más bajas en comparación con las personas que recibieron dos dosis de la vacuna y cuya tasa de infección ajustada por 100 000 días en riesgo de 69,2 (IC del 95 %: 68,8 a 69,8). ) ( Goldberg et al., 2021a). En general, la enfermedad grave fue relativamente rara: al ignorar el momento del último evento que confirió inmunidad, las tasas brutas de enfermedad grave por 100 000 días-persona para personas de 60 años o más fueron 0,6 para los participantes con una infección previa y sin vacunación, 0,5 para los participantes que tuvieron una infección y luego fueron vacunados, 1,1 para los participantes que fueron vacunados (dos dosis) y luego infectados, 4,6 para los participantes vacunados con dos dosis y 0,4 para aquellos que recibieron adicionalmente una vacuna de refuerzo ( Goldberg et al., 2021a). Otra investigación anterior de Israel informó que en 14.029 personas con una infección previa por SARS-CoV-2, aquellos que recibieron una sola dosis de vacuna tenían un riesgo 0,53 veces menor (IC del 95 %: 0,3 a 0,92) de infecciones por SARS-CoV-2 en comparación con individuos previamente infectados no vacunados ( Gazit et al., 2021 ). Al restringir el análisis a las personas que primero se infectaron y luego se vacunaron (es decir, el 81 % de este grupo), la razón de probabilidad fue de 0,68 (IC del 95 %: 0,38 a 1,21) ( Gazit et al., 2021 ).
Una gran encuesta en 1 531 736 personas de Qatar que recibieron dos dosis de una vacuna de ARNm comparó los resultados en personas con infección previa por SARS-CoV-2 versus sin ella ( Abu-Raddad et al., 2021b ). El cociente de riesgos instantáneos ajustado (con un IC del 95 %) para las infecciones por SARS-CoV-2 a los 120 días de seguimiento en el grupo con infección previa versus sin infección previa fue de 0,18 (0,15 a 0,21) para los vacunados con BNT162b2 y de 0,35 (0,25 a 0,48) para los vacunados con mRNA-1273. La comparación de pacientes que se infectaron 6 meses o más antes de la vacunación con aquellos que se infectaron menos de 6 meses antes de la vacunación dio como resultado un cociente de riesgos instantáneos ajustado (IC del 95 %) para infecciones por SARS-CoV-2 de 0,62 (0,42 a 0,92) para la vacuna BNT162b2 y 0,40 (0,18 a 0,91) para la vacuna mRNA-173 ( Abu-Raddad et al., 2021b). Las enfermedades graves fueron muy raras en este estudio sin muerte por COVID-19. Los datos de un estudio de cohorte de base poblacional en 325 157 personas de los Estados Unidos mostraron que entre las personas vacunadas que recibieron dos dosis, las que tenían una infección previa y las que no tenían una infección previa tenían una protección del 86,8 % (IC del 95 %: 74,5 %–93,2 %) frente a la reinfección por el SARS-CoV -2 ( Kim et al., 2021 ). Un estudio de casos y controles entre 738 participantes de Kentucky, Estados Unidos, mostró que los residentes con una infección previa por SARS-CoV-2 que permanecieron sin vacunar tenían una razón de probabilidad de 2,34 (IC del 95 %: 1,58 a 3,47) para las reinfecciones en comparación con las personas previamente infectadas que recibieron la vacunación completa con dos dosis de una vacuna de ARNm o una dosis única de la vacuna Janssen (Johnson & Johnson) ( Cavanaugh et al., 2021). En 2579 trabajadores de la salud de los Estados Unidos previamente infectados por SARS-CoV-2 no hubo una diferencia significativa en las tasas de reinfección entre aquellos sin y con vacunación (dos dosis de una vacuna de ARNm) ya que no ocurrió infección en todo este grupo ( Shrestha et al., 2021 ). Un estudio de cohorte en 13 109 trabajadores de la salud del Reino Unido no informó de diferencias en la infección por SARS-CoV-2 en participantes seropositivos en compararon a aquellos sin y con vacunación (dos dosis de BNT126b2 o ChAdOx1) ( Lumley et al., 2021b ).
Los datos sobre la eficacia de la inmunidad híbrida son inconsistentes, pero apuntan en la dirección de que la inmunidad híbrida es superior en comparación con la inmunidad inducida por la vacuna (sin un refuerzo) o la inmunidad natural sola. Gran parte de esta literatura (y esto se aplica también a casi todos los estudios de la vacuna COVID-19) utiliza medidas de riesgo relativo, que tienden a proporcionar resultados más impresionantes. Sin embargo, las tasas absolutas de eventos y las diferencias absolutas de riesgo serían más informativas para transmitir el nivel de riesgo y su variación en diferentes entornos. Esto es aún más importante para los resultados graves (hospitalización y muerte). Por ejemplo, una reducción del riesgo relativo del 90 % ("eficacia de la vacuna del 90 % para la muerte") puede corresponder a un beneficio absoluto inferior al 0,01 % o incluso inferior al 0,001 %. Los riesgos absolutos y las diferencias de riesgo absoluto dependen del nivel de actividad epidémica.
El momento y el modo de vacunación de individuos previamente infectados para lograr una inmunidad híbrida óptima son preguntas centrales que aún deben abordarse en estudios futuros. Al evaluar los datos nacionales de Israel en comparación con los datos de Qatar y los Estados Unidos, se podría plantear la hipótesis de que dos dosis versus una dosis de una vacuna de ARNm podrían ser más eficaces en el contexto de pacientes previamente infectados, pero esto es muy especulativo ( Abu-Raddad et al. al., 2021b ; Cavanaugh et al., 2021 ; Goldberg et al., 2021a ; Kim et al., 2021). Con respecto al momento óptimo de vacunación, la encuesta de Qatar indica una mayor protección cuando la infección y la vacunación subsiguiente están separadas por al menos 6 meses en comparación con un intervalo más corto, pero estos datos requieren mayor investigación ( Abu-Raddad et al., 2021b ).
Los eventos adversos después de la vacunación de pacientes previamente infectados con SARS-CoV-2 deben evaluarse cuidadosamente en futuros estudios, así como la relación riesgo-beneficio general en esta situación ( Menni et al., 2021 ). Centrarse en los riesgos absolutos es esencial para tales evaluaciones.
3.4 . Consideraciones inmunológicas y futuras ondas y variantes del SARS-CoV2
Se ha documentado que las infecciones por SARS-CoV-2, incluso con enfermedad leve o asintomática, inducen una respuesta inmune humoral y celular robusta ( Kojima y Klausner, 2022 ). Durante la pandemia de COVID-19, se han solicitado con frecuencia mediciones de anticuerpos contra el SARS-CoV-2, pero se debe enfatizar que los anticuerpos son solo predictores incompletos de protección y, en la mayoría de las situaciones, aún no se han establecido justificadamente como parte de un procesos de toma de decisiones ( Breathnach et al., 2021a ; Kojima y Klausner, 2022). En comparación con la vacunación, la respuesta humoral inducida por la infección por SARS-CoV-2 suele ser más variable con concentraciones de anticuerpos más bajas pero dirigidos no solo contra la proteína espiga sino también contra muchos otros marcos de lectura abiertos codificados por los aproximadamente 29 900 nucleótidos de SARS-CoV- 2, y también implica respuesta inmunitaria humoral de las mucosas ( Krammer, 2021 ). La respuesta inmunitaria celular a la infección por SARS-CoV-2 parece ser incluso más poliepitópica que la respuesta humoral con persistencia a largo plazo de células T y B de memoria en pacientes recuperados ( Milne et al., 2021 ; Turner et al., 2021 ).
Con respecto a la protección contra la reinfección por diferentes variantes del SARS-CoV-2, se debe subrayar que la eficacia de la protección fue de una magnitud aproximadamente similar en varias variantes de virus diferentes en 2020-2021 ( Chemaitelly et al., 2021a ; Kim et al., 2021 ) . Sin embargo, los datos sobre la variante Omicron son escasos al momento de escribir esta revisión. Teniendo en cuenta la amplia respuesta inmunológica inducida por las infecciones naturales por SARS-CoV-2 contra todas las partes del virus, parece lógico que incluso las variantes futuras no puedan evadir por completo la inmunidad natural. Sin embargo, se abren muchas preguntas con la aparición de nuevas variantes (por ejemplo, Omicron) que requieren una reevaluación rápida y precisa de nuestro conocimiento actual ( Altarawneh et al., 2022 ;Cristina, 2021 ; Del Río et al., 2022 ; Kupferschmidt y Vogel, 2021). Dado que las tasas de vacunación aumentan continuamente y que, a principios de 2022, quizás la mitad o más de la población mundial ya se ha infectado con el SARS-CoV-2, y la gran mayoría no se detecta oficialmente, parecería lógico que las futuras olas de infección, incluso con variantes altamente transmisibles del SARS-CoV-2, puedan ver limitado su potencial daño para la salud. La aparición de Omicron sugiere que pueden ocurrir picos masivos incluso en poblaciones con tasas extremadamente altas de vacunación previa y tasas variables de infecciones previas. Sin embargo, incluso así, la carga de hospitalizaciones y muertes que la acompañan es mucho menor que la observada en 2020 y la mayor parte de 2021 ( Altarawneh et al., 2022 ; Christie, 2021 ;Kupferschmidt y Vogel, 2021 ; Ulloa et al., 2022 ). Sin embargo, la verdadera carga de las infecciones en curso de Omicron debe investigarse a fondo. Se podría argumentar que la pandemia ya pasó a la fase endémica y que Omicron sería una ola endémica que ocurre en el contexto de una inmunidad generalizada en la población. Las ondas endémicas futuras pueden seguir teniendo un pico alto, pero esto sería manejable si tienen una carga clínica limitada.
4 . Conclusiones
En conclusión, la inmunidad natural adquirida después de las infecciones por SARS-CoV-2 parece ser muy eficaz en términos de protección contra las reinfecciones y, lo que es más importante, contra los resultados graves de COVID-19. La eficacia parece ser igual o mayor en comparación con las personas que reciben dos dosis de ARNm, pero los datos no son completamente consistentes. La inmunidad híbrida, es decir, la inmunidad lograda por la infección por SARS-CoV-2 más la vacunación, parece ser la más protectora. Estas conclusiones deben verse a la luz de las limitaciones de nuestro trabajo, que no se basó en una revisión sistemática y un metanálisis preespecificados y registrados, sino que intentó proporcionar una descripción general actualizada y en evolución sobre varios cuestiones interrelacionadas para actualizar y ampliar el trabajo de revisiones anteriores ( Kojima et al., 2021 ; Petras, 2021 ;Shenai et al., 2021 ).
Aunque describimos claramente la eficacia de la inmunidad natural, queremos enfatizar fuertemente que nadie debe buscar la infección a propósito para eludir la vacunación porque la infección por SARS-CoV-2, independientemente de la variante subyacente, se asocia con resultados adversos notables. Sin embargo, sería imprudente no tener en cuenta las infecciones previas en las consideraciones políticas, dada su alta frecuencia. Esto puede ser aún más importante para los estratos de edad más jóvenes donde el riesgo de resultados graves de la COVID-19 son, en cualquier caso, mucho más bajo ( Ioannidis, 2021b ).
La eficacia y la duración de la inmunidad natural definitivamente serán cruciales para las deliberaciones políticas actuales y aún más para el futuro ( Cheng et al., 2021 ; Dunkle et al., 2021 ; Gentile et al., 2021 ; Gupta et al., 2021 ; Ingram et al., 2021 ; Krause et al., 2021 ; Weinreich et al., 2021 ; Zemb et al., 2020). Sin embargo, persisten enormes lagunas de conocimiento sobre la inmunidad natural, que plantean un desafío para los responsables de la formulación de políticas de salud y que requieren investigaciones adicionales. Será de particular importancia abordar las preguntas sobre cómo incorporar la protección de la inmunidad prevalente en la población general en las decisiones sobre restricciones o medidas de salud pública relacionadas contra el SARS-CoV-2, y si alguna medida de laboratorio de inmunidad protectora (por ejemplo, anticuerpos mediciones o ensayos de inmunidad celular) pueden tener algún valor práctico para la toma de decisiones (y, de ser así, en qué entornos), con respecto a la vacunación o los tratamientos de COVID-19. Es probable que muy pronto, una abrumadora mayoría de personas se haya infectado con el SARS-CoV-2 al menos una vez en su vida.


Gracias por el enorme trabajo. Comentarle que los enlaces a las citas parecen no funcional pues siempre me llevan a https://www.sciencedirect.com/science/article/pii/S0013935122002389#bib122
ResponderEliminarSaludos.
Preguntarle ademas porque las medidas de eficacia se ofrecen siempre como valores relativos y no absolutos, ¿ Como afecta la presentacion en la comprension de los resultados? Atentamente.